وبلاگ همافزایی دانشجویان دکتر حسینی مطلق- motlagh@iust.ac.ir
دانشکده مهندسی صنایع- دانشگاه علم و صنعت ایران
وبلاگ همافزایی دانشجویان دکتر حسینی مطلق- motlagh@iust.ac.ir
دانشکده مهندسی صنایع- دانشگاه علم و صنعت ایرانفاز واکنشی در برابر اختلالات طراحی شبکه تأمین پلاکت فعال

چکیده:
معمولا در مطالعات قبلی در زمینه طراحی شبکه زنجیره تامین خون با توجه به تأثیرات اختلال در مرحله طراحی، از روش های رایج برای محافظت از زنجیره در برابر اختلالات استفاده می کنند. با این حال، در بسیاری از شرایط دنیای واقعی، اختلالات را نمی توان از قبل به اندازه کافی اندازه گیری کرد. علاوه بر این، استفاده از اختلالات در مرحله طراحی از طریق مدل های برنامه ریزی تصادفی دو مرحله ای مشترک، هزینه های زیادی را به شبکه تحمیل می کند، زیرا براساس اختلالات پیش بینی نشده نمی توان آنها را به روز کرد. این مقاله یک رویکرد دو مرحله ای را ارائه می دهد که با اختلالات در مرحله عملیاتی و نه در مرحله طراحی استراتژیک سروکار دارد. در مرحله اول، به نام فاز فعال، یک شبکه زنجیره تأمین پلاکت اسمی تحت عدم قطعیت عملیاتی، با استفاده از روش جمع آوری خون کامل طراحی می شود. در صورت بروز اختلال، مرحله دوم که فاز واکنشی نامیده می شود، اعمال می شود و شبکه متناسب با داده های تحقق یافته و با استفاده از روش آفرزیس به عنوان مکانیسم جمع آوری به روز می شود. خطرات عملیاتی با استفاده از رویکرد برنامه ریزی فازی در مدل گرفته می شوند. بر اساس داده های واقعی استان فارس ایران، عملکرد رویکرد دو مرحله را با رویکردهای رایح در ادبیات مقایسه شده است.
کلیدواژه ها : زنجیره تأمین خون، شبکه پلاکت، فاز فعال، فاز واکنشی، اختلالات، عدم قطعیت مقدمه :
پیری جمعیت یک پدیده جهانی است و تقریباً همه کشورها با افزایش سالمندان در جمعیت خود روبرو هستند که پیش بینی می شود تا سال 2050 نزدیک به 2.1 میلیارد نفر باشد (پیری جمعیت جهان 2017). با افزایش سن، تقاضا برای خدمات بهداشتی و مداخلات پزشکی افزایش می یابد و در نتیجه، هزینه های بالای بهداشتی بر عهده جامعه است (پیر شدن جمعیت جهان در سال 2013 ، 2014). انتقال خون، به عنوان بخشی قابل قبول از خدمات مراقبت های بهداشتی، تحت تأثیر این انتقال جمعیتی قرار خواهد گرفت و پس از آن میزان انتقال خون به طور قابل توجهی رشد می کند. علاوه بر این، پیری جمعیت به ویژه پیری اهدا کنندگان، باعث کاهش جدی اهداکننده خون خواهد شد. کاهش جمعیت اهداکنندگان و رشد تقاضای خون مورد توجه مراکز خون قرار گرفته است. بنابراین ، طراحی یک برنامه کارا برای مدیریت خدمات انتقال خون از اهمیت بالایی برخوردار است. هر سیستم مراقبت بهداشتی کارا نیاز به دسترسی به انتقال خون کافی و ایمن برای انجام درمان های پزشکی معمول یا جراحی دارد. خون به طور معمول به شکل خون کامل جمع می شود که به اجزای مختلفی از جمله گلبول های قرمز، پلاسما، پلاکت و رسوب تقسیم می شود. پلاکت خون گرانترین محصول خون کامل است و مشکل آن طول عمر بسیار کوتاهش (تنها هفت روز) می باشد.
پلاکت ها از طریق تمام جنبه های آزمایش، تولید، ذخیره سازی و توزیع برای استفاده از انتقال خون در بیمارستان ها از اهدا کنندگان جمع می شوند. تزریق پلاکت، طیف وسیعی از کاربردها را در درمان های مختلف از جمله شیمی درمانی، پیوند مغز استخوان، درمان بیماری عروق محیطی و بیماری عروق کرونر، به عنوان یکی از مهمترین دلایل مرگ و میر در کشورهای در حال توسعه است کمک می کند(انصافیان و یعقوبی ، 2017). اخیراً، بیشتر کشورها با شیوع ویروس کرونا (COVID-19) با چالشی غیرمنتظره روبرو شده اند و تعداد قابل توجهی از افراد در سراسر جهان به این ویروس آلوده شده اند. کووید 19 از اول ماه مه سال 2020 جان بیش از 235000 نفر را گرفته است و باعث عواقب اجتماعی و اقتصادی شدیدی در سراسر جهان شده است (ایوانوف ، 2020). بنابراین، محققان قصد دارند این بیماری را با تولید واکسن برای محافظت از افراد در برابر COVID-19 درمان کنند. محققان کشف کرده اند که از خون و فرآورده های آن می توان برای تولید واکسن های ویروس کرونا استفاده کرد (چانگ و همکاران ، 2020). بنابراین، تأمین موثر خون و پلاکت می تواند یک نگرانی اساسی برای کنار آمدن با این وضعیت باشد. پلاکت ها را می توان از اهدای خون کامل یا از طریق روش آفرزیس استخراج کرد. در روش جمع آوری خون کامل، خون از یک اهدا کننده گرفته می شود و در یک کیسه جمع می شود. چندین سیستم برای جمع آوری خون وجود دارد که از نظر تعداد کیسه های متصل متفاوت است. بر اساس کیسه انتخاب شده، زمان و سرعت سانتریفیوژ تعیین می شود. پس از آن، خون کامل به محصولات مورد نظر تقسیم می شود. در روش جمع آوری آفرزیس، کل خون از اهدا کننده گرفته می شود و اجزای خاص خون مانند گلبول های قرمز، پلاسما یا پلاکت از خون اهدا کننده استخراج می شود و باقی مانده به اهدا کننده بازگردانده می شود. واحد پلاکت مشتق شده از آفرزیس معادل 6تا8 واحد پلاکت مشتق از خون است. علاوه بر این، پلاکت مشتق شده از آفرزیس دارای مزایای قابل توجهی در مقایسه با پلاکت مشتق شده از خون کامل از جمله کاهش قرارگرفتن اهداکننده، کاهش خطر ابتلا به بیماری های منتقل شده توسط انتقال خون، سهولت نسبی در تشخیص آلودگی باکتریایی و آماده سازی های بیمارستانی کمتر است. با این حال آفرزیس، فرآیند پرهزینه و زمان بری است و معیارهای خاص واجد شرایط بودن برای اهداکنندگان پلاکت آفرزیس مورد نیاز است. بنابراین بیشتر اهدا کنندگان تمایلی به اهدای خون از طریق روش آفرزیس ندارند. جمع آوری پلاکت آفرزیس می تواند در مراکز تولید (PC) و بیمارستان های مستقر در مجموعه انجام شود و به دلیل نیاز به آماده سازی و روشهای آزمایش کمتر، پلاکت جمع آوری شده می تواند در طی روز جمع آوری و تزریق شود. سپس خون کامل جمع آوری شده تحت آزمایش دقیق و فرآیند غربالگری قرار می گیرد که حدود دو روز طول می کشد. این فرایند آزمایش اجباری، مشکل فسادپذیری را بیش از پیش تشدید می کند و در عمل پلاکت های مشتق شده از خون کامل قابل انتقال و پس از تحویل به بیمارستان ها دارای ماندگاری پنج روزه خواهند بود. مدیریت موجودی پلاکت به دلیل خصوصیات این محصول از جمله عمر بسیار کوتاه، عدم قطعیت تقاضا و عرضه و چندین روش جمع آوری مسئله مهمی در مراکز خون بوده است. تأمین پلاکت تنها به تمایل افراد برای اهدای خون بستگی دارد و در نتیجه با عدم قطعیت روبرو خواهد شد (وانگ و ما ، 2015). در سمت تقاضا، اگرچه بیمارستان ها می توانند تقاضای پلاکت را به دلیل جراحی ها و انتقال های برنامه ریزی شده تخمین بزنند. خواسته های اضافی به طور تصادفی از آسیب ها، تصادفات و موارد اضطراری بهداشت عمومی ناشی می شوند (ناگورنی و دوتا ، 2019). عدم تطابق تقاضا و عرضه که منجر به هدر رفت یا کمبود پلاکت می شود، یک بار اجتماعی و اقتصادی قابل توجهی را بر دوش بیمارستان ها و مراکز خون می گذارد. این موضوعات نیاز به تجدیدنظر در مدیریت موجودی پلاکت ها را به گونه ای افزایش داده است که اجزای زنجیره های تأمین خون (BSC) به روشی هماهنگ با یکدیگر تعامل داشته و کمبود پلاکت و نرخ منسوخ شده را به حداقل برسانند. حمل و نقل جانبی یک استراتژی عملی است که می تواند منعطف بودن مدیریت زنجیره تأمین پلاکت (PSC) را بهبود بخشد. در این استراتژی، واحدهای پلاکت استفاده نشده در یک بیمارستان با بیمارستان دیگری تقسیم می شود تا از مواجهه با شرایط ذخیره سازی جلوگیری کند. بر این اساس استراتژی حمل و نقل می تواند ضمن کاهش هزینه ها، عملکرد زنجیره تأمین را افزایش دهد (وانگ و ما ، 2015). زنجیره های تأمین دچار اختلالات ناشی از بلایای طبیعی مانند حوادث شدید آب و هوایی، سیل و زلزله یا تهدیدات انسانی مانند انفجار، قطع برق و بی ثباتی سیاسی می شوند. این اختلالات می تواند بر ظرفیت تسهیلات، تعداد واحدهای تولیدی، تعداد تقاضاهای ارضا شده تأثیر بگذارد و در نتیجه، آنها در عملکرد مالی و عملیاتی زنجیره های تأثیری تأثیرگذار هستند. براساس گزارش رویداد مختل کننده که در سال 2018 رخ داده است، 552,950 قسمت از زنجیره های مختلف تأمین در سراسر جهان را تحت تأثیر قرار داده است. همچنین، این گزارش نشان داد که تنها 12٪ از زنجیره های تأمین که در معرض خطر اختلال قرار دارند. از آنجا که این موارد مربوط به زندگی انسان است، باید توجه ویژه ای شود تا از عواقب جدی ایجاد اختلال در چنین شبکه هایی جلوگیری شود. خسارت شدید به زیرساخت های خون در زلزله بم در ایران (2003)، آسیب به تجهیزات آزمایش خون در زلزله بزرگ ژاپن شرقی (2011)، اعتصاب کارکنان بانکداری خون در برهامپور و ادیشا در هند (2018)، قطع برق در انتقال خراسان مرکز در ایران (2018)، انفجار بانک خون صنعا در یمن (2018)، مشکلات مالی در سرویس انتقال خون کنیا (2019) و اختلال در تأمین خون در ایالات متحده به دلیل سیکلون بمب، طوفان های فلورانس و مایکل (2018) یادآوری اختلالات احتمالی است که می تواند بر عملکرد PSC تأثیر بگذارد. چنین اختلالات پیش بینی نشده به ندرت اتفاق می افتد و از نظر نوع و مقیاس متفاوت است. علاوه بر این، داده های تاریخی ناقص میباشذ یا هیچ داده تاریخی در مورد آنها وجود ندارد (حسینی و دیگران 2019). بنابراین مدیران و تصمیم گیرندگان باید استراتژیهای کاراتری را برای کنترل تأثیرات حوادث مخرب در نظر بگیرند. در مطالعات اخیر ارائه شده توسط برخی از محققان، استراتژی های فعال برای مقابله با اختلالات در BSCs ارائه شده است. این استراتژی ها، مانند انعطاف پذیری در ظرفیت ها و در نظر گرفتن امکانات پشتیبان در شبکه، برای محافظت از شبکه در برابر اختلالات و افزایش استواری شبکه استفاده می شود. استراتژی های پیشگیرانه هدف جذب اختلالات و کاهش اثرات آنها است. اگر استراتژی های فعال نتوانند به طور کامل اختلال را مهار کنند، کمبودهایی رخ خواهد داد. در این شرایط، باید استراتژی های واکنشی برای انطباق با شبکه و پاسخگویی به کمبودهای ناشی از حوادث مخرب بلافاصله اجرا شود. برای انجام این کار ،یک روش دو مرحله ای را با بهره گیری از استراتژی های فعال و واکنشی برای کنترل عدم قطعیت و اختلالات تولید در PSC پیشنهاد شده است. سواالات اصلی این مقاله به شرح زیر است:
· چگونه می توان زنجیره تامین پلاکت را مدیریت کرد تا هزینه های کل به حداقل برسد و از کمبود و نرخ منسوخ کاسته شود؟
· چگونه می توان تولید بی قاعده پلاکت را ناشی از اختلالات مدیریت کرد؟
· چگونه می توان از چندین روش جمع آوری و تقسیم خون برای مدیریت کارآمد زنجیره تامین پلاکت بهره برد؟
چگونه می توان با عدم قطعیت ها کنار آمد و اثرات آنها را بر عدم تطابق تقاضا و عرضه کاهش داد؟
مرور ادبیات:
در این بخش مهمترین کارهای اخیر در زمینه طراحی و مدیریت BSCها و به ویژه PSC ها، بررسی می شود. چندین مقاله مروری منتشر شده است که BSC ها را از جنبه های مختلف بررسی می کند. در اثری دیگر، Osorio و همکاران(2015) یک مقاله مروری تا سال 2014 منتشر کردند که در آن مقالات بر اساس رده های BSC طبقه بندی شده و تصمیمات مربوط به هر سطح مورد بررسی قرار گرفتند. در این مقاله تولیدات، فرآیندها، مدیریت موجودی و مشخصات داده های PSC را در مرحله اول طراحی شده است، سپس کمبود (از جمله کمبود مرحله اول ناشی از نوسانات تقاضا و عرضه پلاکت ، همراه با کمبود ناشی از اختلالات) با جمع آوری پلاکت از طریق روش آفرزیس برآورده شد و موجودی پلاکت در مرحله دوم مدیریت شد. بنابراین، مرتبط ترین مقالات را به دو دسته اصلی طبقه بندی شده است: طراحی شبکه زنجیره تامین خون (BSCN) و مدیریت موجودی خون. خون را می توان با روش های اهدای خون کامل یا آفرزیس جمع آوری کرد. محصولات خون مشتق شده از آفرزیس بیشتر از محصولات مشتق از خون کامل هزینه دارند. با این حال، بازده محصولات مشتق شده از آفرزیس بیشتر از محصولات مشتق از خون کامل است. بنابراین، تصمیم گیری در مورد به کارگیری روشهای کارآمد جمع آوری خون از اهمیت بالایی برخوردار است. بیشتر مقالات فقط اهدای خون کامل را در نظر گرفته اند و اهدای آفرزیس به ندرت مورد توجه قرار گرفته است. علاوه بر این، خون را می توان از طریق فرایندهای مختلف تقسیم و تجزیه کرد، که هر یک از آنها اجزای مختلف محصولات خون را تولید می کند. چند محقق این ویژگی را در شبکه های پیشنهادی خود در نظر گرفته اند. با توجه به مقالات بررسی شده، رویکردهای پیشگیرانه پیشنهادی در BSC های برای مقابله با اختلالات اجرا می شود که شبکه را قادر می سازد تا حد ممکن تأثیرات اختلالات را جذب کند. اگر استراتژی های پیشگیرانه پیشنهادی نتوانند اثرات اختلالات را کاملاً مهار کنند، این مقالات هیچ استراتژی را پیشنهاد نمی کنند. بنابراین، بهره برداری از یک استراتژی واکنشی برای ارائه پاسخ فوری به اختلال می تواند منعطف بودن شبکه را در برابر اختلالات افزایش دهد.
در این مقاله از استراتژی های فعال و واکنشی به طور همزمان استفاده شده است تا آسیب پذیری کم و سازگاری بالا برای شبکه در برابر اختلالات را فراهم کند و از پلاکت های آفرزیس به عنوان یک طرح پشتیبان برای پاسخگویی به کمبودهای پیش آمده به دلیل اختلالات، تغییرات موجود در خون و کل نوسانات تقاضا استفاده شده است. همچنین، از استراتژی حمل و نقل جانبی برای تسهیل تطابق تقاضا و عرضه استفاده شده است. رویکرد تصادفی دو مرحله ای یکی از رویکردهای پیشگامانه اغلب استفاده شده در ادبیات برای مقابله با اختلالات است. در این مقاله رویکرد تصادفی دو مرحله ای را با رویکرد دو مرحله ای در دو معیار مقایسه شده است: بهره وری هزینه و واحدهای کمبود، که در آن رویکرد دو مرحله ای از عملکرد تصادفی در هر دو اندازه عمل می کند. در رویکرد تصادفی دو مرحله ای، تصمیم گیرندگان از ابتدای افق برنامه ریزی، باعث ایجاد اختلال در تصمیم گیری می شوند که منجر به تصمیم گیری های محافظه کارانه تری می شود و در نتیجه هزینه های بیشتری را به شبکه تحمیل می کند. از طرف دیگر، استراتژی تصادفی محافظت از شبکه در برابر اختلال است. با این حال، اگر نتواند اختلال را به طور کامل مهار کند، هیچ گزینه دیگری برای رفع کمبودها وجود ندارد. از این رو، احتمال بروز کمبود در این روش افزایش می یابد. در این مقاله از رویکرد دو مرحله ای برای طراحی یک شبکه مقرون به صرفه استفاده می کنیم که در برابر کمبود مقاوم تر باشد. ویژگی های اصلی BSCN مانند انواع فرآورده های خونی، سطح سلسله مراتبی زنجیره تأمین، روش جمع آوری فرآورده های خونی، افق برنامه ریزی، دوره زمانی، رویکرد مدل سازی، رویکرد عدم قطعیت، رویکرد اختلال و استراتژی حمل و نقل جانبی، همراه با مطالعه موردی در مقالات در نظر گرفته شده است.
تعریف مسئله:
در این بخش، PSC پیشنهادی در هر دو فاز فعال و واکنش ارائه شده است و پس از آن فرمول های ریاضی این مراحل ارائه می شود.
فاز فعال:
در مرحله اول، PSC را بدون در نظر گرفتن اختلالات طراحی می کنیم. برای انجام این کار، شبکه ای متشکل از گروه های اهدا کننده، مرکز جمع آوری (CC)، مراکز تولید (PC) و بیمارستانها را تشکیل می دهند. در این مرحله، اهدا کنندگان برای اهدا خون خود به CC ها مراجعه می کنند. کل خون از اهدا کنندگان گرفته شده و به PC ارسال می شود. سپس، خون کامل به منظور کاهش خطر بیماری های منتقل شده به بدن در PC آزمایش می شود. وقتی نتایج آزمایش مشخص شد، خون آلوده دور ریخته می شود و خون سالم به سلول های قرمز خون، پلاسما، پلاکت و رسوب تبدیل میگردد. روش آزمایش، جداسازی و تولید به مدت دو روز ادامه دارد. بر این اساس، طول عمر عملی پلاکت پنج روز خواهد بود. در PC ها، پلاکت ها می توانند ذخیره شوند یا به بیمارستان ها منتقل شوند. علاوه بر این، چندین روش تقسیم در PC ها استفاده می شود که نسبت های مختلفی از محصولات خونی را تولید می کند. در مرحله بعدی، پلاکت ها از PC ها به بیمارستان ها منتقل می شوند و برای برآوردن خواسته های بیماران استفاده می شوند. اثر اختلالات و خرابی های احتمالی در تأمین پلاکت در این مرحله در نظر گرفته نشده است. در واقع این مرحله براساس روشی فعال و برآورد منابع بالقوه پلاکت عمل می کند.
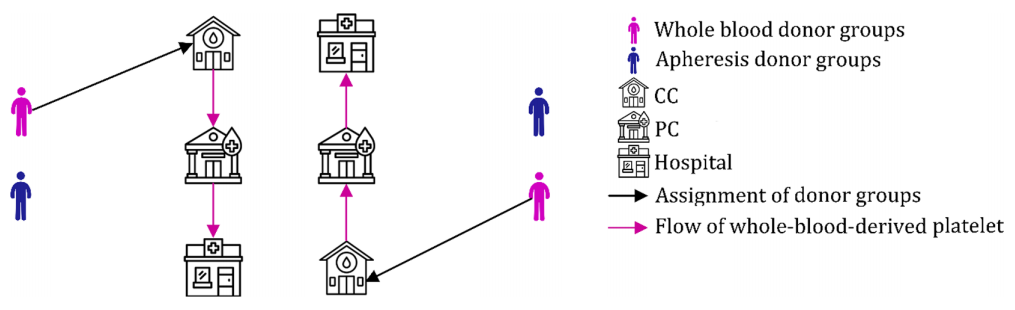
به همین دلیل است که این مرحله را مرحله فعال نامیده شده است . نمای شماتیک PSC پیشنهادی در مرحله اول در شکل بالا نشان داده شده است.
تصمیمات اصلی این مرحله به شرح زیر است:
• مکانیابی بهینه CC ها و PC ها و تخصیص گروه های اهدا کننده به CC ها.
• مقدار بهینه کل خون جمع آوری شده در هر CC.
• جریان خون بین تسهیلات خون.
• سطح نامطلوب و سطح مطلوب موجودی پلاکت های مشتق از خون کامل در PC ها و کمبود پلاکت های خون کامل در بیمارستان ها.
فرضیات زیر در مدل مرحله فعال در نظر گرفته شده است:
• هر گروه اهدا کننده را می توان به یک CC تخصیص داد.
• مراحل آزمایش و تولید پلاکت مشتق از خون به مدت دو روز ادامه دارد.
• میزان دور ریز پلاکت های مشتق از خون کامل در PC ها ثابت است.
• مکان های مطلوب CC و PC ها از مکان های پیشنهادی کاندید شده انتخاب می شوند.
• خون فقط با روش خون کامل جمع آوری می شود.
فرمول ریاضی:
مدل ریاضی فاز اول، یک مدل برنامه ریزی خطی عدد صحیح مختلط، به شرح زیر فرموله شده است .
تابع هدف:
تابع هدف (1) به منظور به حداقل رساندن کل هزینه های زنجیره تامین پیشنهادی، از جمله هزینه تخصیص گروه های اهدا کننده به CC ها، هزینه استقرار CC ها، هزینه بسته های ظرفیت تخصیص شده به CC ها، هزینه جمع آوری خون از اهدا کنندگان و غیره با توجه به فرآیند جمع آوری شده استفاده شده، هزینه حمل واحدهای خون از CC ها به PC ها ، هزینه استقرار PC ها با توجه به ظرفیت های تخصیص شده، هزینه تولید پلاکت در PC ها ، هزینه ذخیره سازی پلاکت های مشتق شده از خون درPC ها، هزینه پلاکت های منقضی شده واحد در PC ها، هزینه حمل واحد پلاکت از PC به بیمارستان و کمبود پلاکت مشتق از خون کامل در بیمارستان میباشد.
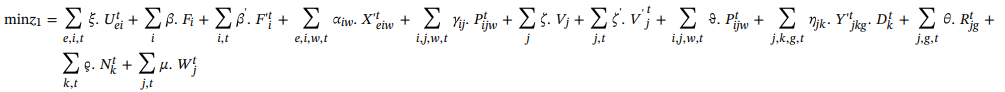
محدودیت ها:
محدودیت (2) تضمین می کند که هر گروه اهدا کننده می تواند به یک CC تخصیص یابد. به عبارت دیگر، در نظر گرفته می شود اهداکنندگانی که در یک گروه اهدا کننده قرار می گیرند، اگر بخواهند خون خود را اهدا کنند، به همان CC مراجعه می کنند. دسترسی به CC، عامل مهمی در تمایل اهداکنندگان برای اهدای خون خود است و در صورت نزدیک بودن CC به آنها، افراد برای اهدا خون به CC مراجعه می کنند. بنابراین، شعاع پوششی را برای CC ها در نظر شده است.

محدودیت (3) بیانگر این است که اگر گروه اهدا کننده در منطقه خدمات CC قرار گیرد، گروه های اهدا کننده می توانند به CC باز شده مراجعه کنند.

محدودیت (4) نشان می دهد که تعداد واحد خون جمع آوری شده از هر گروه اهدا کننده در هر CC باز شده نمی تواند از تعداد اهدا کنندگان بالقوه در آن گروه اهدا کننده بیشتر باشد.

محدودیت (5) نشان می دهد که تعداد واحد خون جمع آوری شده از
هر گروه اهدا کننده در هر CC برابر است با مقدار کل خون جمع آوری شده از آن گروه اهدا کننده از
طریق هر فرآیند جمع آوری.
محدودیت (6) نشان می دهد که جریان خروجی در CC باید کمتر از جریان ورودی در آن CC در هر دوره باشد.

محدودیت (7) تعداد اهدا کنندگان تخصیص شده را به ظرفیت CC محدود می کند. پلاکت های استخراج از اهدای خون کامل، باید در مدت زمان مشخصی به PC ارسال شود.

محدودیت (8) تضمین می کند که اگر زمان حمل و نقل در مدت
مجاز باشد، خون کامل جمع آوری شده به PC منتقل می شود.
محدودیت (9) نشان می دهد که ظرفیت را می توان به یک CC تنها در صورت ایجاد آن CC تخصیص داد.

محدودیت (10) تضمین می کند که تعداد واحدهای پلاکت مشتق از خون کامل که از هر PC به بیمارستان تحویل داده شده اند کمتر از یا برابر با تقاضای پلاکت در آن بیمارستان است. به عبارت دیگر، میزان پلاکت منتقل شده از خون کامل به بیمارستان ها می تواند برابر با تعداد واحدهای پلاکت مورد نیاز در بیمارستان ها باشد. در این صورت تقاضا به طور کامل برآورده می شود. همچنین، می تواند کمتر از تعداد خواسته ها باشد، در این صورت تقاضای ارضا نشده را می توان با پلاکت ذخیره شده، پلاکت مشتق شده از آفرزیس یا پلاکت منتقل شده از بیمارستان های دیگر تأمین کرد. به طور قابل توجهی، سن پلاکت منتقل شده به بیمارستان ها بیش از دو روز است که دلیل آن دو روز آزمایش اجباری است.

با توجه به این فاصله دو روزه، همانطور که توسط محدودیت (11) نشان داده شده است، واحد پلاکتهای یک و دو روزه نمی توانند به منظور تأمین تقاضا در بیمارستانها، به بیماران تخصیص شوند.

محدودیت (12) تضمین می کند که پلاکت را می توان در صورت ایجاد PC از بیمارستان منتقل کرد.

محدودیت (13) نشان میدهد فرآیند تهیه و آزمایش برای هر واحد خون کامل به یک PC دو روز طول می کشد. در نتیجه، هیچ واحد پلاکتی نمی تواند در دوره اول و دوم برنامه ریزی تولید شود.

محدودیت (14) نشان می دهد تعداد واحد پلاکت خون مشتق شده از خون کامل در یک PC را به تعداد واحدهای خون کامل جمع شده در CC ها که با توجه به دوره تولید دو روزه به آن PC منتقل شده اند و تعدادی خون کامل را محدود می کند. واحدها به دلیل دارا بودن عوامل عفونی کنار گذاشته می شوند.

محدودیت (15) ظرفیت PC ها شخصی را نشان می دهد.

محدودیت (16) تعداد بسته های ظرفیت تخصیص یافته PC ها را تعیین می کند. برای جلوگیری از پلاکت ها چندین بار تحریک باید زمان حمل پلاکت باید محدود در نظر گرفته شود.

محدودیت (17) تضمین می کند که اگر زمان سفر در یک بازه زمانی مجاز باشد، پلاکت مجاز به انتقال از PC ها به بیمارستان ها است.

محدودیت (18) نشان می دهد که طول عمر تمام پلاکت های ذخیره شده مشتق از خون کامل بیش از دو روز است.

محدودیت ها (19) و (20) سطح موجودی پلاکت را با طول عمر بیش از سه روز در دوره اول و پلاکت سه روزه در دوره دوم محاسبه می کنند. با توجه به اینکه در دوره اول و دوم پلاکت تولیدی و ذخیره شده ای وجود ندارد، باید تقاضا را با پلاکت موجود در PC ها پاسخگو باشد.

محدودیت
(21) سطح ذخیره سازی را برای طول عمرهای مختلف (g< 4) در دوره دوم محاسبه می کند. در دوره دوم، پلاکت تولیدی وجود
ندارد. بنابراین، تقاضاها باید توسط پلاکت موجود در PC؟ ها و بخشی از پلاکت موجود در دوره اول که ذخیره
شده است، برآورده شود.
محدودیت ها (22) و (23) سطح موجودی پلاکت را در طول عمرهای مختلف برای t< 3 به روز می کنند. در دوره های سوم به بعد، پلاکت تولید می شود و بر این اساس، پلاکت های تولیدی می توانند تقاضای سه روزه پلاکت را تأمین کنند و خواسته ها برای طول عمر بیش از یک روز توسط پلاکت های ذخیره شده در دوره قبلی برآورده می شود.

محدودیت (24) نشان می دهد که پلاکت ذخیره شده در زمان G منقضی می شود.

محدودیت (25) نشان می دهد که تقاضای پلاکت با ورود پلاکت به بیمارستان ها برآورده می شود. در غیر این صورت با کمبود روبرو می شوند.

محدودیت ها (26) - (28) انواع متغیرهای تصمیم گیری را تعیین می کنند.

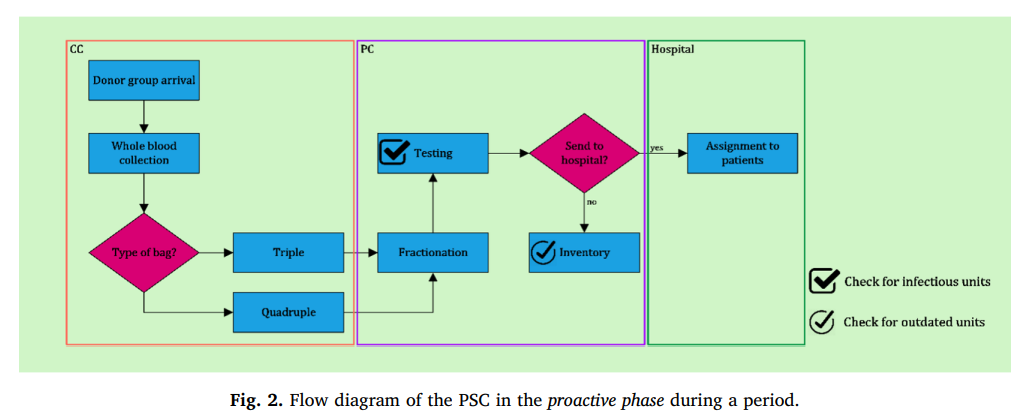
شکل 2 نمودار جریان PSC ارائه شده در مرحله اول را نشان می دهد. پس از حل مدل مرحله اول و تعیین مقادیر متغیرهای تصمیم گیری در این مرحله، یک شبکه PSC طراحی شد. در حال حاضر، ما در اثر اختلال در تولید بر روی شبکه طراحی شده تأثیر می گذاریم. در این مقاله، کل اختلالات در مراکز تولید رخ می دهد و چندین سناریوی اختلال در تولید در مورد تعداد و مراکز تولید تاسیس شده را تعریف می کند. هنگامی که یک PC مختل می شود، نمی تواند واحدهای پلاکت تولید کند. بنابراین، بیمارستانهایی که در مرحله اول با PC مختل شده در شبکه طراحی شده با کمبود روبرو خواهند شد. علاوه بر این، شبکه طراحی شده در مرحله اول به دلیل نوسانات تقاضای پلاکت و خون، ممکن است کمبود داشته باشد که می تواند با پلاکت آفرزیس در مرحله دوم برطرف شود. بنابراین، تعداد کمبودهای ناشی از اختلال، همراه با کمبود مرحله اول، خواسته های فاز دوم خواهد بود و توسط پلاکت های مشتق شده از آفرزیس برآورده می شود. در شبکه های BSC، تأمین خون به طور منظم برای تضمین پاسخگویی به تقاضا مورد نیاز است.
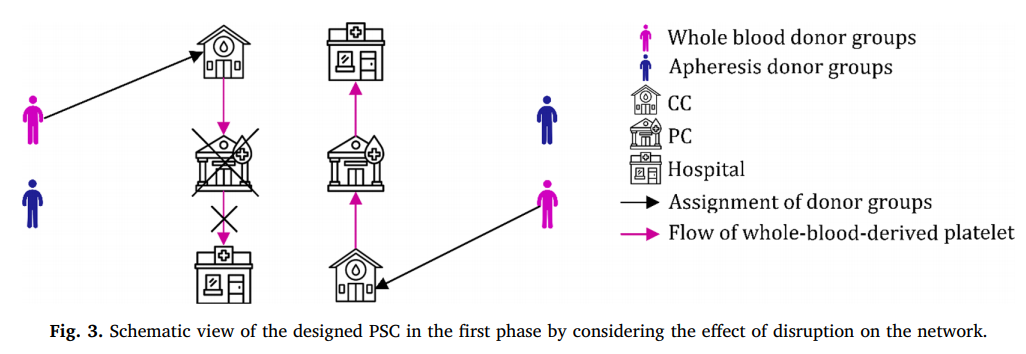
اثر اختلال در شبکه طراحی شده در مرحله اول در شکل 3 نشان داده شده است.
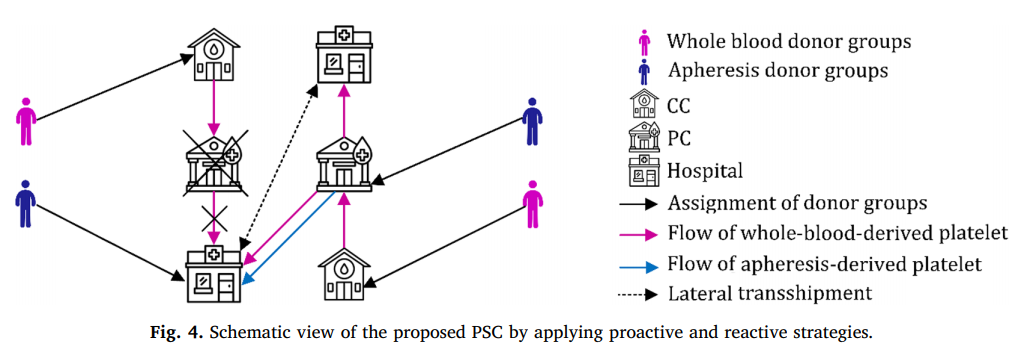
در این مرحله، شبکه طراحی شده در مرحله اول با شرایط جدیدی که از اختلال در PC بوجود می آید سازگار است. در این مقاله از واحدهای پلاکت مشتق شده از آفرزیس به عنوان یک استراتژی واکنشی برای کنترل این وضعیت استفاده می کنیم که همزمان در شبکه با استراتژی فعال در شبکه اجرا می شود. بنابراین، با استفاده همزمان از استراتژی های واکنشی و فعال، تقاضای منظم توسط پلاکت های مشتق شده از خون کامل برآورده می شود.. با این حال، جمع آوری پلاکت از طریق روش آفرزیس، به دلیل کارآیی بالا و روش های تست صرفه جویی در وقت، یک استراتژی کارآمد برای کنترل اختلالات خواهد بود. علاوه بر این، رسیدگی به اختلالات تولید، می توان از این استراتژی برای کنترل سایر اختلالات مانند اختلال تقاضا که در آن تقاضا افزایش می یابد، استفاده کرد. بنابراین، اگر واحدهای پلاکت مشتق از خون کامل نتوانند تقاضا را برآورده کنند، استراتژی واکنشی برای کنترل این وضعیت آغاز می شود. در واقع، این مراحل یکدیگر را کامل می کنند و به طور همزمان برای کنار آمدن موثر با کمبودها استفاده می شوند. در مرحله دوم، پلاکتهای مشتق شده از آفرزیس جمع آوری شده و در بین بیمارستانها توزیع می شوند. این مرحله براساس بخش آشکار داده ها و خروجی های غیرقطعی در مرحله اول، مانند تعداد و محل PC های تاسیس شده، مقدار خون ارسالی از PC به بیمارستان ها و کمبود مرحله اول برنامه ریزی شده است. میزان پلاکت ارسالی از PC های دارای اختلال به بیمارستانها در مرحله اول، همراه با کمبود مرحله اول، به عنوان خواسته های مرحله دوم تحت هر سناریوی اختلال در نظر گرفته می شود که توسط پلاکت جمع آوری شده اهدا کننده ها به روش آفرزیس برآورده می شود. در این مرحله، یک PSC، شامل گروه های اهدا کننده، PC ها و بیمارستانها، مورد استفاده قرار می گیرد. پلاکت از طریق دستگاههای آفرزیس در PC هایو بیمارستانها جمع آوری می شود. پلاکت جمع آوری شده در PC های ذخیره می شود و یا برای استفاده در انتقال به بیمارستان ها ارسال می شود. در بیمارستان ها، واحدهای پلاکت جمع آوری شده، همراه با واحدهای منتقل شده از PC ها، برای برآوردن خواسته ها استفاده می شود و واحدهای باقیمانده را می توان در دوره های بعدی ذخیره کرد. به عبارت دقیق تر، مرحله دوم برنامه ریزی مرحله اول را در واکنش به اختلال رخ داده به روز می کند. بنابراین، مرحله دوم مرحله واکنش نامگذاری شده است. علاوه بر این، این مرحله از یک استراتژی حمل و نقل استفاده می کند که بیمارستان ها را قادر می سازد منابع موجودی خود را به اشتراک بگذارند و خطر کمبود و تاریخ مصرف قبلی را کاهش می دهد. چنین استفاده ترکیبی از روشهای جمع آوری خون کامل و آفرزیس و سیاست انتقال جانبی می تواند یک روش کارآمد برای ساده سازی مطابقت تقاضا و عرضه پلاکت باشد.
تصمیمات اصلی مرحله دوم به شرح زیر است:
• تخصیص گروه های اهدا کننده به PC های و بیمارستان ها.
• مقدار بهینه پلاکت مشتق شده از آفرزیس در هر PC و بیمارستان جمع آوری شده.
• مقدار پلاکت مشتق از آفرزیس از هر PC به هر بیمارستان منتقل شده.
• تعداد مطلوب دستگاههای آفرزیس در هر PC ها و بیمارستان.
• سطح زباله و سطح مطلوب موجودی پلاکت های مشتق از خون کامل در هر PC ها و بیمارستان و سطح کمبود آن در هر بیمارستان.
• مقدار مطلوب پلاکت حمل و نقل شده بین بیمارستان ها.
فرضیات زیر در مدل مرحله فعال در نظر گرفته شده است:
• هر گروه اهدا کننده را می توان به یک PC یا بیمارستان تخصیص داد.
• پلاکت مشتق از آفرزیس جمع آوری شده در روز قابل تزریق است.
• میزان دور انداختن پلاکت های مشتق شده از آفرزیس در PC ها و بیمارستان ها ثابت است.
• مکان PC ها بر اساس خروجی های مرحله اول تعیین می شود.
نمای شماتیک PSC پیشنهادی پس از استفاده از استراتژی های فعال و واکنشی در شکل 4 نشان داده شده است:
تابع هدف :
تابع هدف این مرحله، به منظور به حداقل رساندن کل هزینه های زنجیره تأمین، از جمله هزینه تخصیص گروه های اهدا کننده به PC ها و بیمارستان ها، هزینه دستگاه های آفرزیس در PC ها و بیمارستان ها، هزینه جمع آوری پلاکت در PC ها و بیمارستانی از طریق روش آفرزیس، تولید، ذخیره سازی و انقضا، هزینه پلاکت در PC ها و بیمارستان ها، هزینه حمل پلاکت مشتق شده از آفرزیس از PC ها به بیمارستان، هزینه ذخیره پلاکت مشتق از آفرزیس در بیمارستان ها و هزینه حمل و نقل مجدد واحد پلاکت مشتق شده بین بیمارستان ها می باشد.
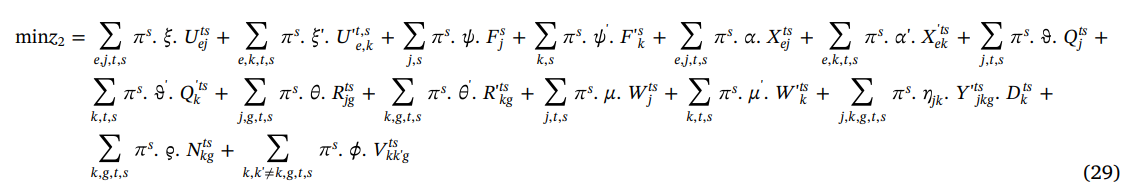
محدودیت ها:
محدودیت (30) نشان می دهد که هر گروه اهدا کننده می تواند از نظر نزدیکی به یک PC بدون اختلال یا یک بیمارستان تخصیص یابد. همانطور که قبلاً گفته شد، مردم برای اهدای خون خود حاضر نیستند به مراکزی که در فاصله دورتر از آنها واقع شده است مراجعه کنند.

محدودیت ها (31) و (32) به ترتیب محدوده خدمات PC ها و بیمارستان ها را به شعاع پوشش آنها محدود می کند.

محدودیت ها (33) و (34) تعداد واحدهای پلاکت مشتق شده از آفرزیس را از هر گروه اهدا کننده به حداکثر تعداد اهداکننده های آفرزیس واجد شرایط آن گروه محدود می کند.

محدودیت (35) تعداد پلاکت های مشتق از آفرزیس تولید شده در یک PC را در هر دوره با توجه به میزان دور ریز، مقدار پلاکت به دست آمده از اهدا کننده و تعداد اهدا کنندگان ارجاع شده به آن PC را در نظر می گیرد.

محدودیت (36) تعداد واحدهای پلاکت تولیدی آفرزیس را در بیمارستان ها تعیین می کند.

محدودیت (37) ظرفیت هر PC را نشان می دهد.

محدودیت (38) زمان حمل واحدهای پلاکت از PC به بیمارستان ها را محدود می کند.

محدودیت (39) تضمین می کند که دستگاههای آفرزیس فقط می توانند به PC بدون اختلال تخصیص داده شوند.

محدودیت (40) نشان می دهد که تعداد واحدهای پلاکت جمع آوری شده در یک بیمارستان، همراه با تعداد پلاکت های وارد شده در آن بیمارستان، کمتر از یا برابر با تقاضای پلاکت در آن بیمارستان است.

محدودیت ها (41) و (42) به ترتیب تعداد واحدهای پلاکت منتقل شده از PC ها به بیمارستان ها را به ترتیب ظرفیت دستگاه های آفرزیس تخصیص داده شده و تعداد پلاکت های جمع آوری شده در PC محدود می کند.

محدودیت (43) تعداد اهداکنندگان ارجاع شده به بیمارستان را به ظرفیت دستگاههای آفرزیس موجود در آن بیمارستان محدود می کند.

محدودیت (44) پلاکت تخصیص شده را برای پاسخگویی به خواسته های بیمارستانی به تعداد پلاکتهای جمع آوری شده در آن بیمارستان محدود می کند.

محدودیت (45) نشان می دهد که می توان از پلاکت تولید شده در هر دوره استفاده کنیم تا خواسته های یک روزه پلاکت را پاسخ دهیم.

محدودیت (46) سطح موجودی PCها را در اولین دوره برای پلاکت های 2 به بعد را به روز می کند، که در این صورت تقاضا ها باید توسط پلاکت موجود در PCها تأمین شود.

محدودیت (47) سطح موجودی PC ها را برای دوره های بعدی طول عمر مشخص محاسبه می کند که در آن تقاضا توسط پلاکت ذخیره شده دوره قبلی برآورده می شود.

محدودیت(48) سطح منسوخ شده پلاکت در PCها را محاسبه می کند.

محدودیت (49) نشان داده شده است که می توان تقاضای یک روزه پلاکت را با تولید پلاکت در هر دوره، همراه با پلاکت انتقال یافته از بیمارستان های دیگر برآورده کرد.
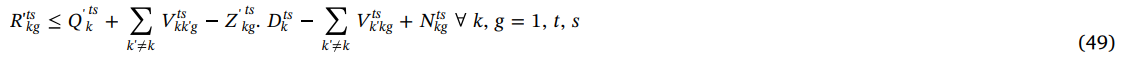
محدودیت (50) نشان می دهد در دوره اول پلاکت مورد نیاز با طول عمر بیش از یک روز، می تواند با پلاکت موجود در بیمارستان و همچنین پلاکت انتقال یافته از بیمارستان های دیگر به آن بیمارستان برطرف شود.
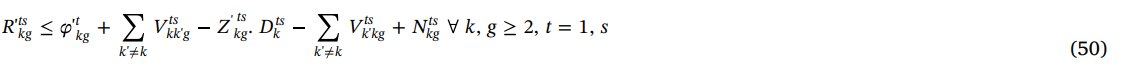
محدودیت (51) نشان می دهد که موجودی پلاکت و واحدهای انتقال یافته از بیمارستان های دیگر برای برآورده سازی خواسته های پلاکت با طول عمر بیش از یک روز استفاده می شود.
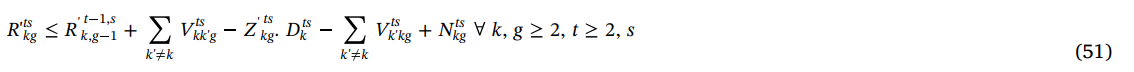
محدودیت (52) میزان دور ریز پلاکت در بیمارستان ها را محاسبه می کنددیت (52) میزان دور ریز پلاکت در بیمارستان ها را محاسبه می کند.

محدودیت (53) نشان می دهد تعداد پلاکت های یک روزه حمل و نقل شده از یک بیمارستان به بیمارستان های دیگر باید کمتر از پلاکت های تولید شده در آن بیمارستان ها باشد.

محدودیت (54) نشان می دهد که در دوره اول، حداکثر مقدار پلاکت بیش از یک روز برابر با مقدار موجود پلاکت ذخیره شده است. بنابراین، میزان پلاکت انتقال یافته باید کمتر از این مقدار باشد.

و محدودیت (55) برای پلاکت بیش از یک روز این کار را انجام می دهد.

محدودیت (56) رضایت از تقاضا برای پلاکت ها در هر طول عمر را در هر دوره تحت هر سناریوی اختلال تضمین می کند.

متغیرهای تصمیم گیری توسط محدودیت ها (57) تا (59) تعیین می شود.
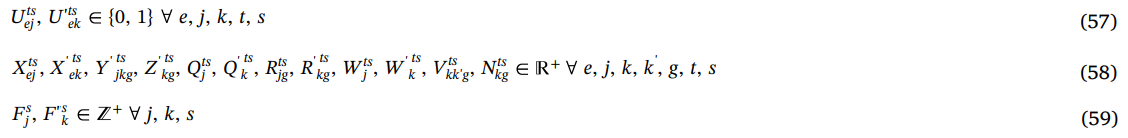
روش حل:
در مدل های پیشنهادی چندین پارامتر از جمله تقاضای
پلاکت، تأمین خون کامل، تأمین پلاکت آفرزیس و هزینه های مرتبط با PSC به عنوان پارامترهای غیر قطعی در نظر گرفته
شده اند. در این مقاله، از یک روش برنامه ریزی تصادفی فازی برای مقابله با عدم
قطعیت استفاده شده است. عدم قطعیت عامل مهمی میباشد که بر طراحی زنجیره تأمین تأثیر
می گذارند و از منابع مختلفی مانند کمبود اطلاعات یا داده های ناقص، شرایط محیطی و
اشتباهات در تخمین عوامل غیرقابل تعیین ناشی می شوند. در عمل، حتی مقدار کمی عدم قطعیت
می تواند به طور قابل توجهی بر عملکرد زنجیره های تأمین تأثیر بگذارد. بر این
اساس، برای مقابله با عدم قطعیت و ایمن سازی زنجیره های تأمین در برابر تأثیرات آن،
باید رویکرد مناسبی در نظر گرفته شود.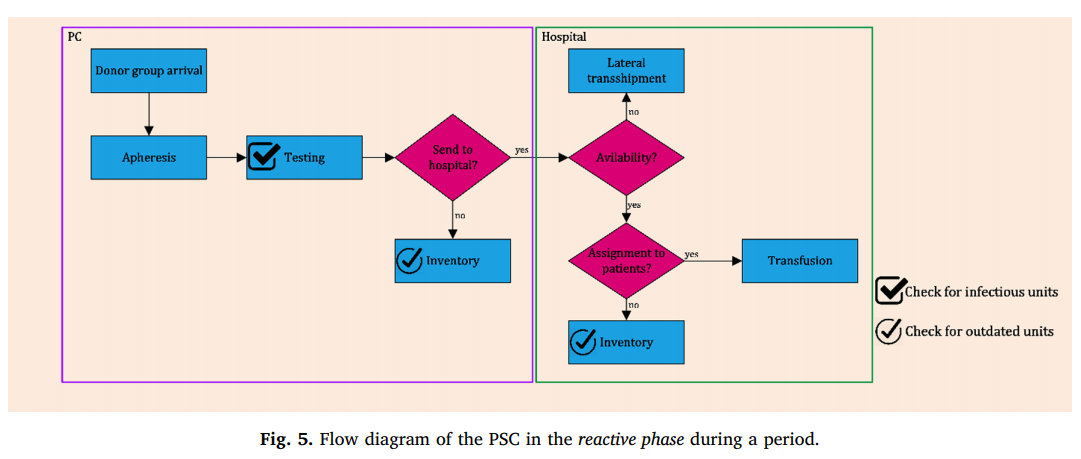
رویکرد برنامه نویسی تصادفی فازی:
فرم مدل های پیشنهادی برای طراحی PSC به شرح زیر فرمول شده است: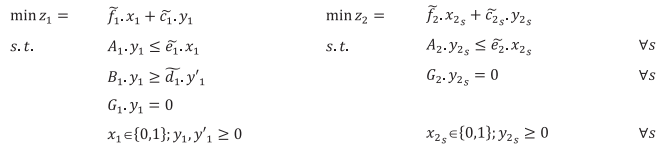
مدل های ارائه شده مربوط به مرحله اول و دوم مسئله PSC پیشنهادی است.
مدل های ارائه شده مربوط به فازهای اول و دوم مسئله PSC پیشنهادی است. A1 ، B1 ، G1 ، A2 ، G2 و G'2 ماتریس مدل ها هستند که حاوی پارامترهای قطعی هستند، و علاوه بر این ، f1 ، c1 ، e1 ، d1 ، f2 ، c2و e2 بردارهای پارامتر فازی هستند. f1 مربوط به هزینه تاسیس مراکز خون و هزینه تخصیص اهداکنندگان به CC است و c1 هزینه متغیر PSC در مرحله اول است. f2 مربوط به هزینه تخصیص گروه های اهدا کننده به PC ها و بیمارستان ها است و c2s هزینه عملیاتی PSC در مرحله دوم تحت سناریو است. x1 و x2 به ترتیب متغیرهای تصمیم باینری هستند که مربوط به فازهای اول و دوم هستند. همچنین ، y1 و y'1 متغیرهای تصمیم گیری مداوم فاز اول هستند و y2s متغیر تصمیم گیری مبتنی بر سناریو فاز دوم را نشان می دهد. سناریوهای اختلال با s نشان داده می شوند ، جمع احتمال آنها یک است.
در مدل ذکر شده در بالا، محدودیت های حاوی پارامترهای فازی به صورت محدودیت های امکانی هستند و از اندازه گیری پیمانه باورپذیری برای تبدیل آنها به فرم واضح معادل بهره برداری می شود. همچنین، برای تدوین برنامه اصلی محدودیت شرطی احتمالی، از امید ریاضی احتمالات توابع هدف در مدل ارائه شده استفاده شده است. بنابراین، فرم فشرده برنامه ریزی محدودیت شرطی احتمالی به صورت زیر تنظیم شده است:
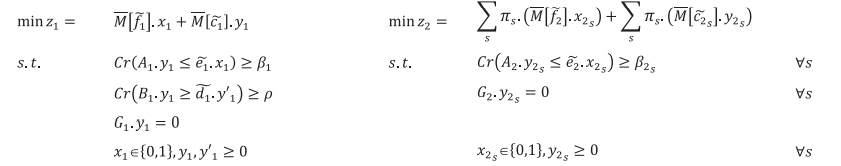
حداقل سطح اطمینان هر محدودیت امکانی توسط تصمیم گیرندگان تعیین می شود که با 1 و در مرحله اول مشخص می شود. در مرحله دوم ، 2s نشان دهنده حداقل سطح اطمینان شرطی است که برای هر سناریوی اختلال متفاوت است.
F1 ، F2 و F2S به صورت زیر محاسبه خواهد شد:
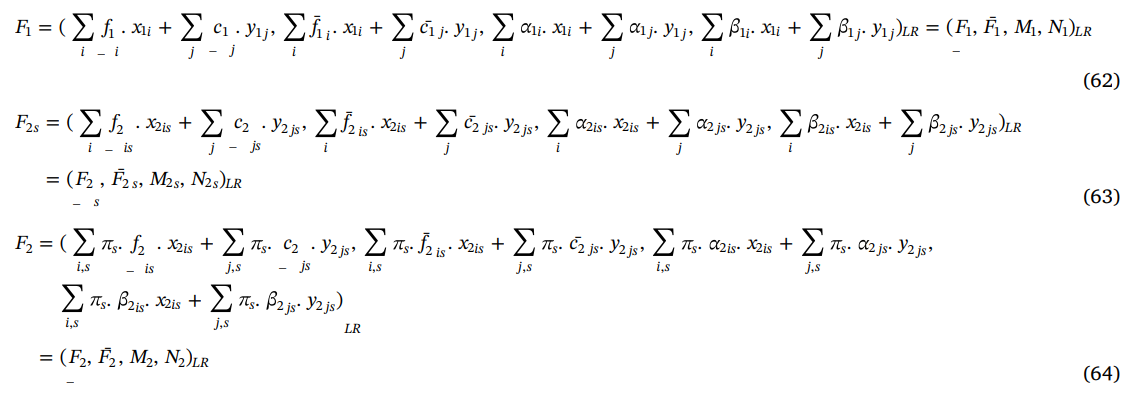
همچنین
، براساس تعریف 3، مقدار میانگین امکانی تابع هدف مرحله اول (F1)، میانگین امکانی تابع هدف مرحله دوم تحت
سناریو (F2s) و وزن
مقدار متوسط امکانی تابع هدف مرحله دوم (F2) را می توان به شرح زیر بیان کرد: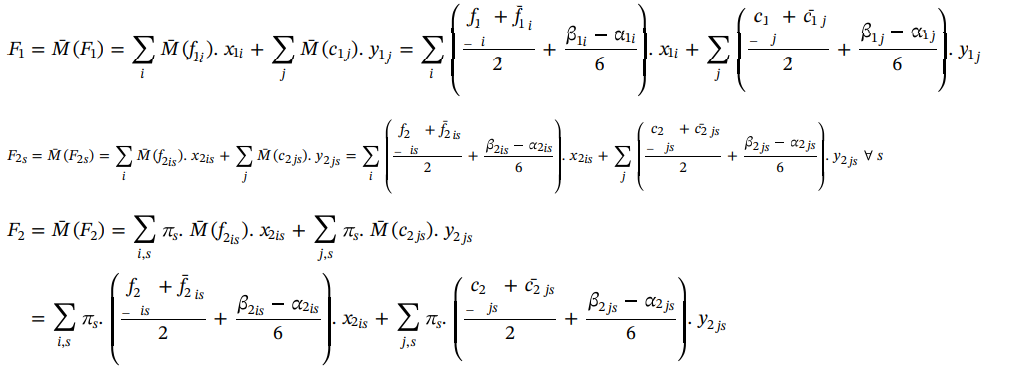
برای دستیابی به هدف پوشش جهانی مراقبت های بهداشتی، هر کشور باید خدمات بهداشتی مانند تأمین ایمن و کافی فرآورده های خونی را به درستی ارائه دهد. در ایران، یک سازمان مسئول جمع آوری، تولید، ذخیره سازی و توزیع خون است. برای این سازمان که سازمان انتقال خون ایران (IBTO) نامیده می شود، ارائه خدمات خون ایمن و کافی در بالاترین اولویت است. دستیابی به این هدف مستلزم تصمیم گیری اساسی در زمینه فعالیتهای مربوط به انتقال خون مانند شناسایی محل بهینه CC ها و pc ها و ظرفیت این مراکز، تعیین روشهای بهینه جمع آوری خون و تقسیم در مراکز خون، تعیین تخصیص بهینه خون به بیمارستان ها و نحوه محافظت در برابر اختلالات است. در هر استان ایران یک مرکز انتقال خون اصلی وجود دارد که مدیریت تأمین خون در این استان را بر عهده دارد. این مقاله به بررسی مشکل طراحی PSC در استان فارس پرداخته است.
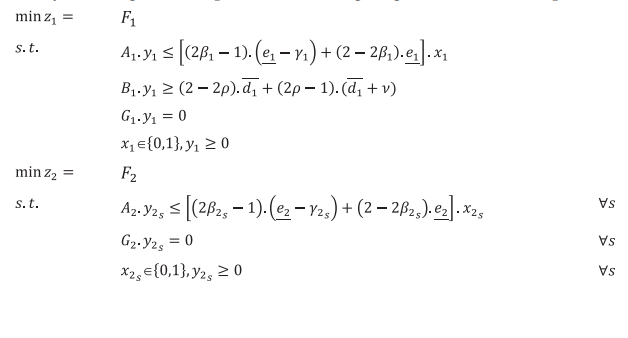
در این حالت حداکثر ماندگاری پلاکت ها هفت روز در نظر گرفته می شود و یک فرآیند آزمایش اجباری دو روزه در تولید پلاکت های مشتق از خون کامل در نظر گرفته می شود. با این حال، پلاکت های مشتق شده از آفرزیس به روش های دقیق آزمایش نیاز ندارند و بنابراین می توان از آنها در روز جمع آوری استفاده کرد. علاوه بر این، یک پلاکت مشتق شده با روش آفرزیس معادل 6 پلاکت مشتق از خون کامل است. همانطور که توسط سازمان بهداشت جهانی (WHO) گزارش شده است، میزان دور انداختن پلاکت در فرآیند تولید 7٪ در نظر گرفته شده است. تقاضای پلاکت توسط بیماران در بیمارستان ها به دلیل حوادث غیرمترقبه همراه با فسادپذیری زیاد پلاکت همچنان غیر قطعی است. بنابراین، تقاضای تخمینی بر اساس داده های تاریخی قابل اعتماد نیست. بر این اساس، تقاضا به عنوان اعداد فازی ارائه می شود به طوری که عناصر این عدد فازی براساس نظرات متخصصان استخراج می شود.
نتیجه گیری:
در این مقاله، بر روی طراحی PSC تحت عدم قطعیت و خطرات اختلال تمرکز شده است. برای انجام این کار، یک رویکرد دو مرحله ای را طراحی شده است که از استراتژی های فعال برای مقابله با عدم قطعیت ها و استراتژی های واکنشی برای مهار اختلالات بهره برداری می کند. برای پرداختن به رویکرد پیشنهادی، در مرحله اول، به نام فاز فعال، یک PSC اسمی تحت عنوان خطرات عملیاتی به عنوان عدم قطعیت تقاضا، عرضه و هزینه تنظیم می شود. از روش فازی برای مقابله با عدم قطعیت استفاده می شود و پلاکت ها با اهدای خون کامل در این مرحله جمع می شوند. با حل مدل این مرحله، مکان تخصیص و تصمیمات ظرفیت قبل از اینکه داده های واقعی خود را نشان دهند، تعیین می شود. تأثیر اختلالات در مرحله اول در نظر گرفته نمی شود. بنابراین، مرحله دوم که فاز واکنشی نامیده می شود، برای مهار تأثیر حوادث مخرب و به روزرسانی طرح ارائه شده در مرحله اول بر اساس بخشی از داده های آشکار شده آغاز می شود. در مرحله واکنشی، کمبودهای ناشی از اختلالات همراه با کمبود واحدهای مرحله اول، توسط پلاکت های جمع آوری شده در PC و بیمارستان ها به روش آفرزیس برآورده می شود. علاوه بر این، رویکرد تصادفی فازی برای مقابله با خطرات اختلال و عملیاتی (تأمین و هزینه) استفاده می شود. روش پیشنهادی در مورد واقعی ایران در استان فارس اجرا می شود و با رویکرد تصادفی دو مرحله ای به عنوان یک روش بیشتر مورد استفاده در ادبیات مقایسه می شود. علاوه بر این، یک سری تجزیه و تحلیل حساسیت انجام شده است. نتایج نشان می دهد که عملکرد روش دو مرحله ای در مقایسه با رویکرد دو مرحله ای از نظر مقدار واحدهای کمبود و هزینه کل زنجیره تأمین به طور قابل توجهی افزایش یافته است. مدل پیشنهادی باعث می شود زنجیره تامین همزمان در برابر اختلالات و کمبود مقاوم باشد. اگرچه تمام رویکردهای پیشگیرانه، مانند رویکرد تصادفی، برای محافظت از شبکه ها در برابر اختلالات است، اما در صورت کمبود، هیچ گزینه دیگری در این روش ها اعمال نمی شود. روش پیشنهادی دو مرحله ای از پلاکتهای مشتق شده از آفرزیس به عنوان یک استراتژی واکنشی برای پاسخ سریع به کمبود استفاده می کند، این کمبود به دلیل عدم تأمین کافی پلاکتهای مشتق از خون کامل یا به دلیل حوادث مخرب است. شبکه پیشنهادی قادر است اثرات اختلالات را به طور موثر جذب کند و برنامه خود را برای افزایش عملکرد شبکه تطبیق دهد که در نتیجه منعطف بودن بیشتری برای شبکه ایجاد می کند. بینش مدیریتی زیر از اجرای رویکرد دو مرحله حاصل می شود:
1) تصمیم گیرندگان PSC می توانند از راهکارهای فعال و واکنشی در برابر اختلالات و خطرات عملیاتی بهره مند شوند. زیرا منجر به زنجیره تأمین کاراتر، مقرون به صرفه و منعطف می شود. استفاده از پلاکتهای مشتق از آفرزیس به دلیل نیاز به چند آماده سازی و روش آزمایش می تواند یک استراتژی مناسب باشد. بنابراین، در صورت کمبود سریعتر پاسخ می دهد.
2) جمع آوری پلاکت از طریق روش آفرزیس در بیمارستان ها به چند دلیل قابل استفاده است: اول، تولید پلاکت کاملاً به pc ها بستگی نخواهد داشت. بنابراین، در صورت بروز اختلال در pcها ، زنجیره تأمین می تواند تقاضا را از طریق پلاکت آفرزیس برآورده کند. دوم، کمبود، سریعتر پاسخ داده خواهد شد.
3) تصمیم گیرندگان می توانند شبکه پیشنهادی را درباره نتایج مرحله اول و دوم برنامه ریزی مجدد کنند تا تلاش های لازم پس از حوادث مخرب را کاهش دهند. (به عنوان مثال، برای کاهش تعداد پلاکتهای آفرزیس جمع شده پس از ایجاد اختلال). بنابراین، نه تنها شبکه می تواند به طور موثر اختلال ایجاد کند، بلکه وابستگی کمتری به پلاکت مشتق شده از آفرزیس خواهد داشت. در واقع، ما وابستگی کمتری به این روش دادیم، زیرا در برخی کشورها اهدا کنندگان خون خود را از طریق روش آفرزیس کمتر اهدا می کنند.
4) در نظر گرفتن منطقه خدماتی برای مراکز خون (CC و PC) از چندین نظر مفید است: 1) این ویژگی منجر به پراکندگی مناسب مراکز خون می شود. بنابراین، تمایل اهدا کنندگان برای اهدای خون به دلیل دسترسی بهتر به CC ها افزایش می یابد. 2) این ویژگی مراکز افتتاح شده را برای پراکنده کردن در سراسر منطقه برای تحت پوشش قرار دادن گروه های اهدا کننده بیشتر اعمال می کند و منجر به جمع آوری پلاکت از گروههای مختلف اهدا کننده می شود و زنجیره تأمین به تعداد محدود اهدا کنندگان بستگی نخواهد داشت. 3) با توجه به این ویژگی، تازگی پلاکت به دلیل توزیع مناسب مراکز حفظ خواهد شد. 4) مدیران می توانند با آگاهی از خدمات بالقوه مورد نیاز برای خدمات دهی به مراکز مربوطه، شبکه را بهتر مدیریت کنند.